Đề cương ôn tập Hóa học 9 - Năm học 2019-2020
Bài 2: Nêu hiện tượng quan sát được và viết PTHH xảy ra, ghi rõ điều kiện phản ứng (nếu có):
- Cho mẫu kẽm vào ống nghiệm chứa dd HCl(dư)
- Cho mẫu nhôm vào ống nghiệm chứa H2SO4 đặc, nguội.
- Cho dây nhôm vào dd NaOH đặc.
- Cho từ từ dd BaCl2 vào ống nghiệm chứa dd H2SO4.
- Cho từ từ dd BaCl2 vào ống nghiệm chứa dd Na2CO3.
- Cho từ từ dd HCl vào ống nghiệm chưá dd NaOH có để sẵn 1 mẫu giấy quỳ tím.
- Cho đinh sắt vào ống nghiệm chứa dd CuSO4.
- Cho dd NaOH từ từ vào ống nghiệm chứa dd CuSO4. sau đó lọc lấy chất kết tủa rồi đun nhẹ.
- Cho từ từ dd AgNO3 vào ống nghiệm chứa dd NaCl.
- Cho lá đồng vào ống nghiệm chứa dd HCl.
- Đốt nóng đỏ một đoạn dây sắt cho vào bình chứa khí oxi.
- Cho dây bạc vào ống nghiệm chứa dd CuSO4.
- Cho Na(r) vào cốc nước có pha phenolphtalein.
- Rắc bột Al lên ngọn lửa đèn cồn.
- Đun nóng ống nghiệm chứa Cu(OH)2.
Bài 3: Cho các chất sau: CuO, Al, MgO, Fe(OH)2, Fe2O3. Chất nào ở trên tác dụng với dd HCl để:
- Sinh ra chất khí nhẹ hơn không khí và cháy được trong không khí.
- Tạo thành dd có màu xanh lam.
- Tạo thành dd có màu vàng nâu.
- Tạo thành dd không màu.
Viết các PTHH cho các phản ứng trên.
Bài 4: Cho các chất: Na2CO3, BaCl2, BaCO3, Cu(OH)2, Fe, ZnO. Chất nào ở trên phản ứng với dd H2SO4 loãng để tạo thành:
- Chất kết tủa màu trắng.
- Khí nhẹ hơn không khí và cháy được trong không khí.
- Khí nặng hơn không khí và không duy trì sự cháy.
- Chất kết tủa màu trắng đồng thời có chất khí nặng hơn không khí và không duy trì sự cháy.
- Dd có màu xanh lam.
- Dd không màu.
Viết các PTHH cho các phản ứng trên.
Bạn đang xem tài liệu "Đề cương ôn tập Hóa học 9 - Năm học 2019-2020", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập Hóa học 9 - Năm học 2019-2020
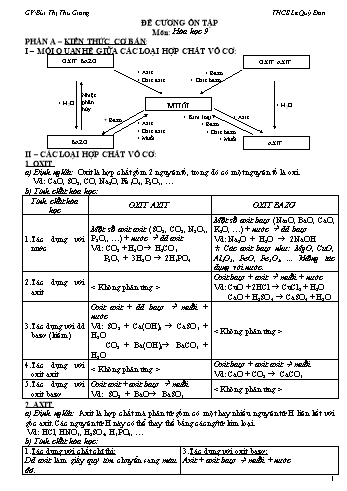
Vd: SO2 + Ca(OH)2 ® CaSO3 + H2O CO2 + Ba(OH)2® BaCO3 + H2O Tác dụng với oxit axit Oxit bazơ + oxit axit à muối Vd: CaO + CO2 ® CaCO3 Tác dụng với oxit bazơ Oxit axit + oxit bazơ à muối Vd: SO2 + BaO ® BaSO3 2. AXIT a) Định nghĩa: Axit là hợp chất mà phân tử gồm có một hay nhiều nguyên tử H liên kết với gốc axit. Các nguyên tử H này có thể thay thế bằng các ng/tử kim loại. Vd: HCl, HNO3, H2SO4, H3PO4, b) Tính chất hóa học: Tác dụng với chất chỉ thị: Dd axit làm giấy quỳ tím chuyển sang màu đỏ. Tác dụng với kim loại: Một số dd axit (HCl, H2SO4 loãng) + các kim loại đứng trước H (trong dãy HĐHH của kim loại) à muối + H2 Vd: 2Al + 3H2SO4loãng ® Al2(SO4)3 +3H2 Zn + 2HCl ® ZnCl2 + H2 Ø H2SO4 đặc và HNO3 tác dụng với hầu hết các kim loại tạo muối nhưng không giải phóng khí H2. Vd: Cu + 2H2 SO4đặc ® CuSO4 + SO2 + 2H2O Ø H2SO4 đặc có tính háo nước. Tác dụng với oxit bazơ: Axit + oxit bazơ à muối + nước Vd: CaO + H2SO4 ® CaSO4 + H2O Tác dụng với bazơ: Axit + bazơ à muối + nước (phản ứng trung hòa) Vd: 2Fe(OH)3 + 3H2SO4 ® Fe2(SO4)3 + 6H2O Tác dụng với muối: Axit + muối à muối mới + axit mới Vd: H2SO4 + BaCl2 ® BaSO4 + 2HCl 2HCl + Na2CO 3 ® 2NaCl + H2O + CO2 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. Ø Sản xuất axit sunfuric: Gồm các công đoạn sau: (1) S + O2 SO2 (2) 2SO2 + O2 2SO3 V2O5 (3) SO3 + H2O ® H2SO4 3. BAZƠ a) Định nghĩa: Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (OH). Vd: KOH, NaOH, Ba(OH)2 , Al(OH)3, b) Tính chất hóa học: Tác dụng với chất chỉ thị: Dd bazơ làm giấy quỳ tím chuyển sang màu xanh, dd phenolphtalein chuyển sang màu đỏ. Tác dụng với oxit axit: Dd bazơ + oxit axit à muối + nước Vd: Ca(OH)2 + SO3 ® CaSO4 + H2O Tác dụng với axit: Bazơ + axit à muối + nước (phản ứng trung hòa) Vd: NaOH + HCl ® NaCl + H2O Tác dụng với muối: Dd bazơ + dd muối à muối mới + bazơ mới Vd: Ba(OH) 2 + CuSO4 ® BaSO4 + Cu(O...xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. 3. Tác dụng với bazơ: Dd muối + dd bazơ à muối mới + bazơ mới Vd: CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan. 4. Tác dụng với muối: Muối + muối à 2 muối mới Vd: NaCl + AgNO3 ® AgCl + NaNO3 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan. 5. Phản ứng nhiệt phân hủy: t0 Một số muối bị phân hủy ở nhiệt độ cao: Vd: CaCO3 ® CaO + CO2 c) Phản ứng trao đổi: Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. Vd: BaCl2 + H2SO4 ® BaSO4 + 2HCl Na2CO 3 + 2HCl ® 2NaCl + H2O + CO2 CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4 NaCl + AgNO3 ® AgCl + NaNO3 Điều kiện để phản ứng trao đổi xảy ra: Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí. Ø Lưu ý: Phản ứng trung hòa cũng là phản ứng trao đổi và luôn xảy ra. Vd: NaOH + HCl ® NaCl + H2O III – KIM LOẠI: 1. TÍNH CHẤT CHUNG CỦA KIM LOẠI a) Tính chất vật lý: Có tính dẻo, dễ dát mỏng và dễ kéo sợi. Dẫn điện và dẫn nhiệt tốt. (Ag là kim loại dẫn điện và dẫn nhiệt tốt nhất, tiếp theo là Cu, Al, Fe, ) Có ánh kim. b) Tính chất hóa học: Tác dụng với phi kim: Thường ở nhiệt độ cao. t0 Với khí oxi: Tạo oxit. Vd: 3Fe + 2O2 ® Fe3O4 t0 t0 Với các phi kim khác (Cl2, S, ): Tạo muối. Vd: 2Na + Cl2 ® 2NaCl ; Fe + S ® FeS Tác dụng với dd axit: Kim loại đứng trước H (trong dãy HĐHH của kim loại) + dd axit (HCl, H2SO4 loãng) à muối + H2 Vd: 2Al + 3H2SO4loãng ® Al2(SO4)3 +3H2 Ø H2SO4 đặc, nóng và HNO3 tác dụng với hầu hết các kim loại (trừ Pt, Au) tạo thành muối nhưng không giải phóng hidro Tác dụng với nước: Một số kim loại (Na, K, ...) + nước à dd kiềm + H2 Vd: 2Na +2H2O ® 2NaOH + H2 Tác dụng với muối: Muối + kim loại à muối mới + kim loại mới Vd: Fe + CuSO4 ® FeSO4 + Cu Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag Ø Lưu... là Al2O3), than cốc, khơng khí. Điện phn nĩng chảy criolit Phương pháp: điện phân nóng chảy. 2Al2O3 4Al + 3O2 2. DY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI Theo chiều giảm dần độ hoạt động của kim loại: K, Na, Ca, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au Ý nghĩa dy hoạt động hóa học của kim loại: Mức độ họat động hóa học của kim loại giảm dần từ trái qua phải. Kim loại đứng trước Mg tác dụng với nước ở điều kiện thường à kiềm và khí hiđro. Kim loại đứng trước H phản ứng với một số dd axit (HCl, H2SO4 loãng, ) à khí H2. Kim loại đứng trước (trừ Na, K) đẩy kim loại đứng sau ra khỏi dung dịch muối. 3. HỢP CHẤT SẮT: GANG, THP a) Hợp kim: Là chất rắn thu được sau khi làm nguội hỗn hợp nóng chảy của nhiều kim loại khác nhau hoặc hỗn hợp kim loại và phi kim. b) Thành phần, tính chất và sản xuất gang, thép: Hợp kim GANG THÉP Thành phần Hàm lượng cacbon 2 – 5%; 1 – 3% các nguyên tố P, Si, S, Mn; còn lại là Fe. Hàm lượng cacbon dưới 2%; dưới 0,8% các nguyên tố P, S, Mn; còn lại là Fe. Tính chất Giòn, không rèn, không dát mỏng được. Đàn hồi, dẻo (rèn, dát mỏng, kéo sợi được), cứng. Sản xuất Trong lò cao. Nguyên tắc: CO khử các oxit sắt ở t0 cao. 3CO + Fe2O3 ® 3CO2 + 2Fe Trong lò luyện thép. Nguyên tắc: Oxi hóa các nguyên tố C, Mn, Si, S, P, có trong gang. FeO + C ® Fe + CO IV – PHI KIM: 1. TÍNH CHẤT CHUNG CỦA PHI KIM a) Tính chất vật lý: Ở điều kiện thường, phi kim tồn tại ở cả 3 trạng thái: rắn (S, P, ...) ; lỏng (Br2) ; khí (Cl2, O2, N2, H2, ...). Phần lớn các nguyên tố phi kim không có ánh kim, dẫn điện, dẫn nhiệt kém; Nhiệt độ nóng chảy thấp. Một số phi kim độc như: Cl2, Br2, I2. b) Tính chất hóa học: Tác dụng với kim loại: t0 Nhiều phi kim + kim loại à muối: Vd: 2Na + Cl2 ® 2NaCl t0 Oxi + kim loại à oxit: Vd: 2Cu + O2 ® 2CuO Tác dụng với hiđro: Oxi + khí hiđro à hơi nước 2H2 + O2 ® 2H2O t0 Clo + khí hiđro à khí hiđro clorua H2 + Cl2 ® 2HCl Nhiều phi kim khác (C, S, Br2, ...) phản ứng với khí hiđro tạo thành
File đính kèm:
 de_cuong_on_tap_hoa_hoc_9_nam_hoc_2019_2020.doc
de_cuong_on_tap_hoa_hoc_9_nam_hoc_2019_2020.doc

