Tài liệu ôn thi THPT Quốc gia môn Hóa học - Chuyên đề 2: Kim loại kiềm, kim loại kiềm thổ, nhôm - Năm học 2019-2020
1. Tác dụng với phi kim
Hầu hết các kim loại kiềm có thể khử được các phi kim. Ví dụ, kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hoá -1 :
2Na + O2 ® Na2O2 (r)
Natri tác dụng với oxi trong không khí khô ở nhiệt độ phòng, tạo ra Na2O :
4Na + O2 ® 2Na2O (r)
2. Tác dụng với axit
Các kim loại kiềm đều có thể khử dễ dàng ion H+ của dung dịch axit (HCl, H2SO4 loãng) thành khí H2 (phản ứng gây nổ nguy hiểm)
2M + 2H+ ® 2M+ + H2
3. Tác dụng với nước
Kim loại kiềm khử được nước dễ dàng, giải phóng khí hiđro
2M + H2O ® 2MOH + H2
Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hoả.
IV. Ứng dụng và điều chế
1. Ứng dụng của kim loại kiềm
Kim loại kiềm có nhiều ứng dụng quan trọng :
Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,...
Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài loại lò phản ứng hạt nhân.
Kim loại xesi dùng chế tạo tế bào quang điện.
Kim loại kiềm được dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt luyện.
Kim loại kiềm được dùng làm chất xúc tác trong nhiều phản ứng hữu cơ.
2. Điều chế kim loại kiềm
Kim loại kiềm dễ bị oxi hoá thành ion dương, do vậy trong tự nhiên kim loại kiềm chỉ tồn tại ở dạng hợp chất.
Điều chế kim loại kiềm bằng cách khử ion của chúng :
M+ + e ® M
Tuy nhiên, không có chất nào khử được ion kim loại kiềm.
Phương pháp duy nhất điều chế kim loại kiềm là điện phân nóng chảy hợp chất halogenua của kim loại kiềm.
Ví dụ, điện phân muối NaCl nóng chảy.
Để hạ nhiệt độ nóng chảy của NaCl ở 800oC xuống nhiệt độ thấp hơn, người ta dùng hỗn hợp gồm 2 phần NaCl và 3 phần CaCl2 theo khối lượng. Hỗn hợp này có nhiệt độ nóng chảy dưới 600oC. Cực dương (anot) bằng than chì (graphit), cực âm (catot) bằng thép. Giữa hai cực có vách ngăn bằng thép.
Tóm tắt nội dung tài liệu: Tài liệu ôn thi THPT Quốc gia môn Hóa học - Chuyên đề 2: Kim loại kiềm, kim loại kiềm thổ, nhôm - Năm học 2019-2020
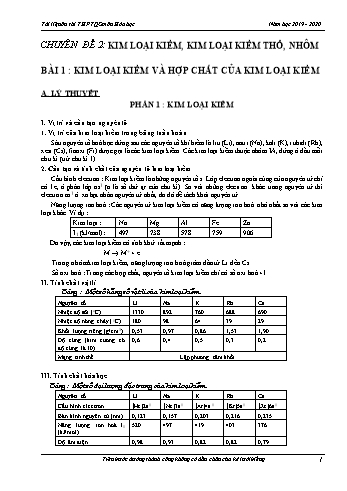
tính khử rất mạnh : M ® M+ + e Trong nhóm kim loại kiềm, năng lượng ion hoá giảm dần từ Li đến Cs. Số oxi hoá : Trong các hợp chất, nguyên tố kim loại kiềm chỉ có số oxi hoá +1. II. Tính chất vật lí Bảng : Một số hằng số vật lí của kim loại kiềm Nguyên tố Li Na K Rb Cs Nhiệt độ sôi (oC) 1330 892 760 688 690 Nhiệt độ nóng chảy (oC) 180 98 64 39 29 Khối lượng riêng (g/cm3) 0,53 0,97 0,86 1,53 1,90 Độ cứng (kim cương có độ cứng là 10) 0,6 0,4 0,5 0,3 0,2 Mạng tinh thể Lập phương tâm khối III. Tính chất hóa học Bảng : Một số đại lượng đặc trưng của kim loại kiềm Nguyên tố Li Na K Rb Cs Cấu hình electron [He]2s1 [Ne]3s1 [Ar]4s1 [Kr]5s1 [Xe]6s1 Bán kính nguyên tử (nm) 0,123 0,157 0,203 0,216 0,235 Năng lượng ion hoá I1 (kJ/mol) 520 497 419 403 376 Độ âm điện 0,98 0,93 0,82 0,82 0,79 Các nguyên tử kim loại kiềm đều có năng lượng ion hoá thấp. Vì vậy kim loại kiềm có tính khử rất mạnh. 1. Tác dụng với phi kim Hầu hết các kim loại kiềm có thể khử được các phi kim. Ví dụ, kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hoá -1 : 2Na + O2 ® Na2O2 (r) Natri tác dụng với oxi trong không khí khô ở nhiệt độ phòng, tạo ra Na2O : 4Na + O2 ® 2Na2O (r) 2. Tác dụng với axit Các kim loại kiềm đều có thể khử dễ dàng ion H+ của dung dịch axit (HCl, H2SO4 loãng) thành khí H2 (phản ứng gây nổ nguy hiểm) 2M + 2H+ ® 2M+ + H2 3. Tác dụng với nước Kim loại kiềm khử được nước dễ dàng, giải phóng khí hiđro 2M + H2O ® 2MOH + H2 Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hoả. IV. Ứng dụng và điều chế 1. Ứng dụng của kim loại kiềm Kim loại kiềm có nhiều ứng dụng quan trọng : Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,... Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài loại lò phản ứng hạt nhân. Kim loại xesi dùng chế tạo tế bào quang điện. Kim loại kiềm... hoá ion Cl– thành Cl2 : 2Cl– ® Cl2 + 2e Phương trình điện phân : 2NaCl 2Na + Cl2 PHẦN 2 : MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM I. Natri hiđroxit, NaOH 1. Tính chất Natri hiđroxit là chất rắn, không màu, dễ hút ẩm, dễ nóng chảy (322oC), tan nhiều trong nước. Natri hiđroxit là bazơ mạnh, khi tan trong nước nó phân li hoàn toàn thành ion : NaOH ® Na+ + OH– Tác dụng với axit, oxit axit tạo thành muối và nước. Tác dụng với một số dung dịch muối, tạo ra bazơ không tan. Ví dụ : Cu2+ + 2OH– ® Cu(OH)2 2. Điều chế Điện phân dung dịch NaCl (có vách ngăn) : 2NaCl + 2H2O H2 + Cl2 + 2NaOH Dung dịch NaOH thu được có lẫn nhiều NaCl. Người ta cho dung dịch bay hơi nước nhiều lần, NaCl ít tan so với NaOH nên kết tinh trước. Tách NaCl ra khỏi dung dịch, còn lại là dung dịch NaOH. II. Natri hiđrocacbonat và natri cacbonat 1. Natri hiđrocacbonat, NaHCO3 a. Tính chất NaHCO3 ít tan trong nước. Bị phân huỷ bởi nhiệt : 2NaHCO3 Na2CO3 + H2O + CO2 Tính lưỡng tính : - NaHCO3 là muối của axit yếu, tác dụng được với nhiều axit : NaHCO3 + HCl ® NaCl + H2O + CO2 HCO3- + H+ ® H2O + CO2 Trong phản ứng này, ion HCO3- nhận proton, thể hiện tính chất của bazơ. - NaHCO3 là muối axit, tác dụng được với dung dịch bazơ tạo ra muối trung hoà : NaHCO3 + NaOH ® Na2CO3 + H2O HCO3- + OH– ® CO32- + H2O Trong phản ứng này, ion HCO3- nhường proton, thể hiện tính chất của axit. ● Nhận xét : Muối NaHCO3 có tính lưỡng tính, là tính chất của ion HCO3- : Khi tác dụng với axit, nó thể hiện tính bazơ ; khi tác dụng với bazơ, nó thể hiện tính axit. Tuy nhiên, tính bazơ chiếm ưu thế nên dung dịch NaHCO3 có tính bazơ. b. Ứng dụng Natri hiđrocacbonat được dùng trong y học, công nghệ thực phẩm, chế tạo nước giải khát,... 2. Natri cacbonat, Na2CO3 a. Tính chất Natri cacbonat dễ tan trong nước, nóng chảy ở 850oC. Na2CO3 là muối của axit yếu, tác dụng được với nhiều axit : Na2CO3 + 2HCl ® 2NaCl + H2O + CO2 CO32- + 2H+ ® H2O + CO2 Ion CO32- nhận ...chu kì. Câu 3: Nguyên tử của các kim loại trong trong nhóm IA khác nhau về A. số electron lớp ngoài cùng của nguyên tử. B. cấu hình electron nguyên tử. C. số oxi hoá của nguyên tử trong hợp chất. D. kiểu mạng tinh thể của đơn chất. Câu 4: Câu nào sau đây mô tả đúng sự biến đổi tính chất của các kim loại kiềm theo chiều điện tính hạt nhân tăng dần ? A. Bán kính nguyên tử giảm dần. B. Nhiệt độ nóng chảy tăng dần. C. Năng lượng ion hoá I1 của nguyên tử giảm dần. D. Khối lượng riêng của đơn chất giảm dần. Câu 5: Các ion nào sau đây đều có cấu hình 1s22s22p6 ? A. Na+, Ca2+, Al3+. B. K+, Ca2+, Mg2+. C. Na+, Mg2+, Al3+. D. Ca2+, Mg2+, Al3+. Câu 6: Khi cắt miếng Na kim loại để ở ngoài không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi, đó là do Na đã bị oxi hóa bởi những chất nào trong không khí? A. O2. B. H2O. C. CO2. D. Cả O2 và H2O. Câu 7: Nhóm các kim loại nào sau đây đều tác dụng được với nước tạo dung dịch kiềm? A. Na, K, Mg, Ca. B. Be, Mg, Ca, Ba. C. Ba, Na, K, Ca. D. K, Na, Ca, Al. Câu 8: Để điều chế kim loại Na, người ta thực hiện phản ứng A. điện phân dung dịch NaOH. B. điện phân nóng chảy NaCl hoặc NaOH. C. cho dung dịch NaOH tác dụng với dung dịch HCl. D. cho dung dịch NaOH tác dụng với H2O. Câu 9: Kim loại kiềm có nhiều ứng dụng quan trọng : (1) Chế tạo các hợp kim có nhiệt độ nóng chảy thấp ; (2) Kim loại Na và K dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân ; (3) Kim loại xesi dùng làm tế bào quang điện ; (4) Các kim loại Na, K dùng để điều chế các ddung dịch bazơ ; (5) kim loại kiềm dùng để điều chế các kim loại hiếm bằng phương pháp nhiệt luyện. Phát biểu đúng là A. 1, 2, 3, 5. B. 1, 2, 3, 4. C. 1, 3, 4, 5. D. 1, 2, 4, 5. Câu 10: Chất nào sau đây khi cho vào nước không làm thay đổi pH? A. NH4Cl. B. KCl. C. Na2CO3. D. HCl. Câu 11: Cho các dung dịch sau: NaOH ; NaHCO3 ; Na2CO3 ; NaHSO4; Na2SO4. Dung dịch làm cho quỳ tím đổi màu xanh là A. NaOH ; Na2SO4 ; Na2CO3. B. NaHSO4 ; NaHCO3 ; Na2CO3.
File đính kèm:
 tai_lieu_on_thi_thpt_quoc_gia_mon_hoa_hoc_chuyen_de_2_kim_lo.doc
tai_lieu_on_thi_thpt_quoc_gia_mon_hoa_hoc_chuyen_de_2_kim_lo.doc

