Ôn tập Hóa học Lớp 10 - Halogen - Trường THPT Đoàn Kết
Bạn đang xem tài liệu "Ôn tập Hóa học Lớp 10 - Halogen - Trường THPT Đoàn Kết", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Ôn tập Hóa học Lớp 10 - Halogen - Trường THPT Đoàn Kết
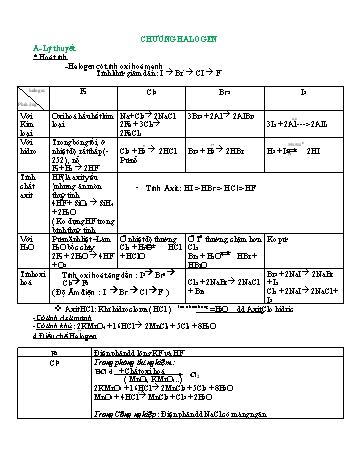
CHƯƠNG HALOGEN A- Lý thuyết * Hoá tính -Halogen có tính oxi hoá mạnh Tính khử giảm dần : I- Br- Cl- F- halogen F2 Cl2 Br2 I2 Phản ứng Với Oxi hoá hầu hết kim Na+ Cl2 2NaCl 3Br2 + 2Al 2AlBr3 H2O Kim loại 2Fe + 3Cl2 3I2 + 2Al ---> 2AlI3 loại 2FeCl3 Với Trong bóng tối, ở 0 as T0 350-500 hidro nhiệt độ rất thấp (- Cl2 + H2 2HCl Br2 + H2 2HBr H2 + I2Pt 2HI 252) , nổ Pứ nổ F2+ H2 2HF Tính HF(là axit yếu chất )nhưng ăn mòn - Tính Axit : HI > HBr > HCl > HF axit thuỷ tinh 4HF + SiO2 SiH4 + 2H2O ( Ko đựng HF trong bình thuỷ tinh Với Pứ mãnh liệt –Làm Ở nhiệt độ thường Ở T0 thường, chậm hơn Ko pứ H2O H2O bốc cháy Cl2 + H2O HCl Cl2 2F2 + 2H2O 4HF + HClO Br2 + H2O HBr + + O2 HBrO Tínhoxi Tính oxi hoá tăng dần : I2 Br2 Br2 + 2NaI 2NaBr hoá Cl2 F2 Cl2 + 2NaBr 2NaCl + I2 ( Độ Âm điện : I Br Cl F ) + Br2 Cl2 + 2NaI 2NaCl + I2 Tan nhiều trong ❖ Axit HCl : Khí hidroclorua ( HCl ) =H2O dd Axit Clo hidric -Có tính Axít mạnh -Có tính khử : 2KMnO4 + 16HCl 2MnCl2 + 5Cl2 + 8H2O 0 4.Điều chế HalogenT F2 Điện phân dd lỏng KF và HF Cl2 Trong phòng thí nghiệm : + Chất oxi hoá HCl đ Cl2 ( MnO2, KMnO4..) 2KMnO4 + 16HCl 2MnCl2 + 5Cl2 + 8H2O T0 MnO2 + 4HCl MnCl2 + Cl2 + 2H2O Trong Công nghiệp : Điện phân dd NaCl có màng ngăn điện phân dd 2NaCl + 2H2O 2NaOH + Cl2 + H2 Có màng ngăn Nếu không màng ngăn : Thu được nước Javen và H2 Br2 Cl2 +2 NaBr 2 NaCl + Br2 ( NaBr có trong nước biển ) I2 Từ rong biển HCl Trong phòng thí nghiệm : Phương pháp sanfat NaCl(tinh thẩ ) + H2SO4 đặc NaHSO4 + HCl NaCl(tinh thẩ ) + H2SO4 đặc NaHSO4 + HCl Trong công nghiệp: Cl2 + H2 2HCl *.Nhận biết - Nhận biết X bằng dd AgNO3 - - - - AgNO3 Cl Br I F AgCl ( Trắng ) AgBr ( vàng nhạt ) AgI ( vàng ) AgF AgNO3 + NaCl AgCl AgNO3 + NaBr AgNO3 + NaI AgI ( tan ) +NaNO3 AgBr NaNO3 +NaNO3 B. CÁC DẠNG BÀI TẬP DẠNG 1: HOÀN THÀNH SƠ ĐỒ PHẢN ỨNG. Bài 1: Viết các phương trình phản ứng xảy ra cho các sơ đồ sau: a. HCl Cl2 FeCl3 NaCl HCl CuCl2 AgCl b. KMnO4 Cl2 HCl FeCl3 AgCl Cl2 Br2 I2 c. KMnO4 → Cl2 → HCl →FeCl2 → AgCl → Ag d. HCl → Cl2→ FeCl3 → Fe(OH)3 → Fe2(SO4)3 e. HCl → Cl2 → NaCl → HCl → CuCl2 → AgCl → Ag f. MnO2 → Cl2 → KClO3 → KCl → HCl → Cl2 → Clorua vôi Bài 2: Hãy biểu diễn sơ đồ biến đổi các chất sau bằng phương trình hoá học: a. NaCl + H2SO4→ Khí (A) + (B) b. (A) + MnO2→ Khí (C) + rắn (D) + (E) c. (C) + NaBr → (F) + (G) d. (F) + NaI → (H) + (I) e. (G) + AgNO3→ (J) + (K) f. (A) + NaOH → (G) + (E) Bài 3: Xác định A, B, C, D và hoàn thành các phương trình phản ứng sau: a. MnO2 + (A) → MnCl2 + (B)↑ + (C) b. (B) + H2 → (A) c. (A) + (D) → FeCl2 + H2 d. (B) + (D) → FeCl3 e. (B) + (C) → (A) + HClO DẠNG 2: NHẬN BIẾT - GIẢI THÍCH HIỆN TƯỢNG – ĐIỀU CHẾ Bài 4: Nhận biết các dung dịch mất nhãn sau bằng phương pháp hoá học: a. KOH , KCl, K2SO4 , KNO3 c.NaCl, HCl, KOH, NaNO3, HNO3, Ba(OH)2 b. HCl, NaOH, Ba(OH)2 , Na2SO4 d. NaCl, NaBr, NaI, HCl, H2SO4, NaOH Bài 5: Dùng phản ứng hoá học nhận biết các dung dịch sau: a. CaCl2, NaNO3, HCl, HNO3, NaOH c. NH4Cl, FeCl3, MgCl2, AlCl3 b. KCl, KNO3, K2SO4, K2CO3 d. Chỉ dùng quì tím: Na2SO4, NaOH, HCl, Ba(OH)2 Bài 6: Giải thích các hiện tượng sau, viết phương trình phản ứng: a. Cho luồng khí clo qua dung dịch kali bromua một thời gian dài. b. Thêm dần dần nước clo vào dung dịch kali iotua có chứa sẵn một ít tinh bột. c. Đưa ra ánh sáng ống nghiệm đựng bạc clorua có nhỏ thêm ít giọt dung dịch quỳ tím. d. Sục khí lưu huỳnh đioxit vào dung dịch nước brom. e. Tại sao có thể điều chế nước clo nhưng không thể điều chế nước flo? Bài 7: a. Từ MnO 2, HCl đặc, Fe hãy viết các phương trình phản ứng điều chế Cl 2, FeCl2 và FeCl3. b. Từ muối ăn, nước và các thiết bị cần thiết, hãy viết các phương trình phản ứng điều chế Cl2 , HCl và nước Javel . DẠNG 3: TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC Bài 8: Xác định nồng độ mol của dung dịch KI biết rằng 200 ml dung dịch đó tác dụng hết với khí Cl2 thì giải phóng 76,2 g I2. Bài 9: Tính khối lượng HCl bị oxi hoá bởi MnO2, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được 12,7g I2 từ dung dịch NaI. DẠNG 4: XÁC ĐỊNH TÊN KIM LOẠI, PHI KIM Bài 10: Điện phân nóng chảy một muối 11,7g halogenua NaX người ta thu được 2,24 lít khí (đktc). a. Xác định nguyên tố X ? b. Tính thế tích khí HX thu được khi người ta cho X tác dụng với 4,48 lít H2 ở đktc ? c. Tính tỷ lệ % các khí sau phản ứng ? Bài 11:Cho một lượng đơn chất halogen tác dụng hết với magie thu được 19g magie halogenua. Cũng lượng đơn chất halogen đó tác dụng hết với nhôm tạo ra 17,8g nhôm halogenua. Xác định tên halogen trên. Bài 12:Cho 4,8 g một kim loại R thuộc nhóm IIA tác dụng hết với dung dịch HCl, thu được 4,48 lít khí H2 (đktc). a. Viết phương trình hóa học của phản ứng xảy ra và tính số mol hiđro thu được. b. Xác định tên kim loại R. c. Tính khối lượng muối khan thu được Bài 13:Để hoà tan hoàn toàn 8,1g một kim loại thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2M, thu được dung dịch A và V lít khí H2 (đktc). a. Xác định nguyên tử khối của kim loại trên, cho biết tên của kim loại đó. b. Tính giá trị V. c. Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể. Bài 14:Khi cho m (g) kim loại canxi tác dụng hoàn toàn với 17,92 lít khí X2 (đktc) thì thu được 88,8g muối halogenua. a. Viết PTPƯ dạng tổng quát. b. Xác định công thức chất khí X2 đã dùng. c. Tính giá trị m. Bài 15:Cho 10,8g kim loại hoá trị III tác dụng với clo tạo thành 53,4g muối. a. Xác định tên kim loại. b. Tính lượng mangan dioxit và thể tích dung dịch axit clohidric 37% (d = 1,19 g/ml) cần dùng để điều chế lượng clo trong phản ứng trên, biết hiệu suất của phản ứng điều chế clo là 80%. Bài 16 : Hòa tan 16 g oxit của kim loại R hóa trị III cần dùng 109,5 g dung dịch HCl 20%. Xác định tên R. Bài 17:Hòa tan 15,3 g oxit của kim loại M hóa trị II vào một lượng dung dịch HCl 18,25% thu được 20,8 g muối. Xác định tên M và khối lượng dung dịch HCl đã dùng. Bài 18:Hòa tan 27,6g muối R2CO3 vào một lượng dung dịch HCl 2M thu được 29,8 g muối. Xác định tên R và thể tích dung dịch HCl đã dùng. Bài 19:Hòa tan hoàn toàn 1,7g hỗn hợp X gồm Zn và kim loại (A) ở nhóm IIA vào dung dịch axit HCl thu được 0,672 lít khí H2 (đktc). Mặt khác nếu hòa tan hết 1,9g (A) thì dùng không hết 200ml dd HCl 0,5M.Tìm tên A. DẠNG 5: BÀI TẬP HỖN HỢP Bài 20:Cho 16g hỗn hợp X gồm Fe và Mg tác dụng hoàn toàn với dung dịch HCl thì thu được 8,96 lit khí ở đktc. Tính khối lượng của Fe và Mg trong hỗn hợp ban đầu. Bài 21:Cho 0,56g hỗn hợp A gồm Mg và Cu tác dụng với dung dịch HCl dư . Sau phản ứng thu được 224ml khí H2 đktc. a. Viết phương trình phản ứng và xác định vai trò của từng chất trong phản ứng b. Tính thành phần % của từng kim loại trong hỗn hợp ban đầu Bài 22:Để hòa tan hoàn toàn hỗn hợp gồm Zn và ZnO người ta phải dung vừa hết 600 ml dd HCl 1M và thu được 0,2 mol khí H2 . a. Viết phương trình hóa học của phản ứng xảy ra, cho biết phản ứng nào là phản ứng oxh-khử. b. Xác định khối lượng của Zn và ZnO trong hỗn hợp ban đầu. Bài 23:Hoà tan 10g hỗn hợp bột Fe và Fe2O3 bằng một lượng dd HCl vừa đủ, thu được 1,12 l hidro (đktc) và dd X. Cho dd X tác dụng với dd NaOH lấy dư. Lấy kết tủa thu được đem nung trong không khí đến khối lượng không đổi thu được chất rắn Y. Tìm khối lượng chất rắn Y. Bài 24:Hoà tan 28,8 gam hỗn hợp bột Fe2O3 và Cu bằng dd HCl dư (không có oxi), đến khi phản ứng hoàn toàn còn 6,4 gam Cu không tan. Tìm khối lượng Fe2O3 và Cu trong hỗn hợp ban đầu. Bài 25:Cho 14,4g hỗn hợp X gồm Cu và CuO tác dụng vừa đủ với 500ml dung dịch HCl 0,4M. Tính khối lượng của đồng trong hỗn hợp ban đầu. Bài 26:Hoà tan hoàn toàn 1,36 gam hỗn hợp CaO và CuO vào lượng vừa đủ 400ml dung dịch HCl 0,1M a. viết các phương trình phản ứng xảy ra? b. Tính thành phần % khối lượng mỗi chất trong hỗn hợp? c. Tính khối lượng các muói tạo thành sau phản ứng? Bài 27:Hoà tan hoàn toàn 8 gam hỗn hợp Fe và Fe2O3 bằng dung dịch HCl 10% (d=1,1 g/ml) sau phản ứng thu được 2,24 lit H2 (đktc). a. Tính thành phần % khối lượng các chất trong hỗn hợp? b. Tính nồng độ mol/l của các chất trong dung dịch sau phản ứng (coi thể tích dd thay đổi không đáng kể). DẠNG 6 : XÁC ĐỊNH HAI HALOGEN LIÊN TIẾP BẰNG PP NGUYÊN TỬ KHỐI TRUNG BÌNH. Bài 28:Cho 3,87 gam hỗn hợp muối natri của hai halogen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa . Tìm tên hai halogen . Bài 29:Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Tính phần trăm khối lượng của NaX trong hỗn hợp ban đầu Bài 30:Cho dung dịch chứa 10 gam hỗn hợp gồm hai muối KX và KY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 14,35 gam kết tủa. Tính phần trăm khối lượng của KX trong hỗn hợp ban đầu . Bài 31:Cho 16,15 gam dung dịch hỗn hợp hai muối NaX, NaY ( X, Y là hai halogen liên tiếp ) tác dụng với dung dịch AgNO3dư thu được 33,15 gam kết tủa trắng. Tìm X và Y . Bài 32:Cho dung dịch chứa 10 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 7,175 gam kết tủa. Tính phần trăm khối lượng của NaX trong hỗn hợp ban đầu. Bài 33:Cho 12,65 gam dung dịch hỗn hợp hai muối NaX, NaY ( X, Y là hai halogen liên tiếp ) tác dụng với dung dịch AgNO3 dư thu được 21,15 gam kết tủa trắng. Tìm X và Y . DẠNG 7: PP TĂNG GIẢM KHỐI LƯỢNG Bài 34:Dẫn Cl2 vào 200 gam dung dịch KBr. Sau khi phản ứng hoàn toàn khối lượng muối tạo thành nhỏ hơn khối lượng muối ban đầu là 4,45 gam. Tính nồng độ phần trăm KBr trong dung dịch ban đầu. Bài 35:Cho Cl2 tác dụng với 30,9 gam NaBr sau một thời gian thu được 26,45 gam muối X. Tính hiệu suất của phản ứng. Bài 36:Cho Cl2 dư tác dụng hoàn toàn với 50 gam hỗn hợp X ( gồm NaCl và KBr ) thu được 41,1 gam muối khan Y. Tính % khối lượng của muối NaCl có trong X ? Bài 37:Cho Br2 dư qua 41,45 gam hỗn hợp A gồm ( NaCl, NaBr, NaI ) thu được 36,75 gam hỗn hợp muối B, tiếp tục cho Cl 2 dư qua B thu được 23,4 gam hỗn hợp muối C. Tính % khối lượng muối NaBr trong A. Bài 38:Có một hỗn hợp gồm NaCl và NaBr, trong đó NaBr chiếm 10% về khối lượng. Hoà tan hỗn hợp vào nước rồi cho khí clo lội qua dd cho đến dư. Làm bay hơi dd cho đến khi thu được muối khan. Khối lượng hh đầu đã thay đổi bao nhiêu %? Bài 39:Để làm sạch 5g Br2 có lẫn tạp chất là Cl 2 người ta phải dùng một lượng dd chứa 1,6g KBr. Sau phản ứng làm bay hơi dd thì thu được 1,155g muối khan. Hãy xác định tỷ lệ % khối lượng Cl2 trong Br2 đem phản ứng? DẠNG 8: BÀI TẬP VỀ HIỆU SUẤT Bài 40:Nung 12,87 g NaCl với H2SO4 đặc, dư thu được bao nhiêu lít khí ở đktc và bao nhiêu gam muối Na2SO4, biết hiệu suất của phản ứng là H= 90%. Bài 41:Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2 (ở đktc) nếu H của phản ứng là 75%. Bài 42:Cho 26,1 g MnO2 tác dụng với dung dịch HCl dư thu được 6,048 lít Cl2 (ở đktc).Tính hiệu suất của phản ứng. Bài 43:Cho 2,24 lít H2 tác dụng với 3,36 lít Cl2 thu được khí X. Cho X tác dụng với dung dịch AgNO3 dư thu được 11,48gam kết tủa trắng. Tính hiệu suất của phản ứng ? Bài 44:Cho 1 lít (đktc) H2 tác dụng với 0,672 lít Cl 2 (đktc) rồi hòa tan sản phẩm vào nước để được 20 gam dụng dịch A. Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 0,17 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước). Bài 45:Hỗn hợp 2,016 lít (đktc) khí A gồm H 2 và Cl2 có tỉ khối hơi đối với heli là 8,1667. Nung A thu được B. Sục B qua dung dịch AgNO3, thu được 8,16 gam kết tủa. a. Tính thành phần phần trăm theo thể tích các khí trong A. b. Tính thành phần phần trăm theo thể tích các khí trong B. c. Tính hiệu suất của phản ứng giữa H2 và Cl2. DẠNG 9: BÀI TẬP Cl2 + (NaOH, KOH) 0 Bài 46:Cho 0,896 lít Cl2 tác dụng với 200 ml dung dịch NaOH 1M ở t thường thu được dung dịch X. Tính CM của các chất trong dung dịch X ? Bài 47:Cho hỗn hợp X gồm 0,1 mol Cl2 và 0,15 mol Br2 tác dụng với 200 ml dung dịch Y gồm NaOH 1M và KOH 1M.Phản ứng xảy ra ở nhiệt độ thường, tính khối lượng muối clorua thu được sau phản ứng ? Bài 48:Cho 2,24 lít khí Cl2 (đktc) tác dụng với 100ml dung dịch X gồm NaOH 2M và Ca(OH)2 0,5M ở nhiệt độ thường. Tính khối lượng muối clorua thu được ? Bài 49:Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch NaOH 4M (ở nhiệt độ thường). a. Viết phương trình hoá học của các phản ứng xảy ra. b. Xác định nồng độ mol của những chất có trong dung dịch sau phản ứng (thể tích dd thay đổi không đáng kể). DẠNG 10: PP BẢO TOÀN E + PP BẢO TOÀN KHỐI LƯỢNG Bài 50: Hòa tan 10,14 gam hỗn hợp Cu, Mg, Al bằng một lượng vừa đủ dung dịch HCl thu được 7,84 lít khí A (đktc) và 6,4 gam chất rắn B, dung dịch C. Cô cạn dung dịch C thu được m gam muối.Tìm m. Bài 51:Hòa tan hoàn toàn 20 gam hỗn hợp Mg, Al và Fe vào dung dịch axit HCl dư thấy có 11,2 lít khí thoát ra (đktc) và dung dịch X. Cô cạn dung dịch X thì khối lượng muối khan thu được là bao nhiêu? Bài 52:Hòa tan hết 38,60 gam hỗn hợp gồm Fe và kim loại M trong dung dịch HCl dư thấy thoát ra 14,56 lít H2 (đktc). Tìm khối lượng hỗn hợp muối clorua khan thu được. Bài 53:Cho 5,1 gam hỗn hợp Al, Zn và Mg tác dụng với dung dịch HCl dư thu được 2,8 lít khí (đktc). Cô cạn dung dịch thu được m gam muối khan. Tìm m. Bài 54:Cho 8,3 gam hỗn hợp Al, Fe, Mg tác dụng hết với dung dịch HCl. Sau phản ứng khối lượng dung dịch HCl tăng thêm 7,8 gam. Khối lượng muối tạo ra trong dung dịch là: Bài 55:1,75 gam hỗn hợp gồm 3 kim loại Fe, Al, Zn tan hết trong dung dịch HCl thì thu được 1,12 khí (đktc) và dung dịch X. Cô cạn X thu được m gam muối. Tìm m. Bài 56:Cho 23,1 gam hỗn hợp X ( gồm Cl2 và Br2 ) có tỉ lệ mol 1:1 tác dụng vừa đủ với 8,85gam hỗn hợp Y ( Fe và Zn) Tính % khối lượng của Fe trong Y ? Bài 57:Cho 6,72 lít hỗn hợp X ( O2 và Cl2 ) có tỉ khối so với H2 là 22,5 tác dụng vừa đủ với hỗn hợp Y ( Al và Mg ) thu được 23,7 gam hh clorua và oxit của hai kim loại. Tính % về khối lượng các chất trong X và Y. Bài 58:Cho 11,2 lít hh khí gồm Cl2 và O2 ở đktc tác dụng vừa hết với 16,98g hh gồm Mg và Al tạo ra 42,34g hh muối clorua và oxit của 2 kim loại đó. a) Tính thành phần % về thể tích của từng chất trong hh A. b) Tính thành phần % của mỗi chất trong B. C. TRẮC NGHIỆM Câu 1: Cho dãy dung dịch axit sau HF, HCl, HBr, HI. Dung dịch có tính axit mạnh nhất và tính khử mạnh nhất là: A. HF B. HCl C. HBr D. HI Câu 2: Nung 8,1gam bột nhôm với 38,1gam iot , biết hiệu suất phản ứng là 80%. Lượng Iotua nhôm thu được là : A. 81,6g B. 97,92g C. 65,28g D. 102g Câu 3: Khi sục chất khí nào sau đây vào dung dịch KI có hồ tinh bột thì sau phản ứng dung dịch có màu xanh: A. Cl2 B. O3 C. O2 D. Cl2, O3 Câu 4: Cho NaI rắn vào bình dung dịch H2SO4đđ nóng dư. Sau khi phản ứng kết thúc thêm vài giọt hồ tinh bột vào bình phản ứng thì dung dịch sẽ có màu: A. Nâu B. Đỏ C. Tím D. Xanh Câu 5: Tính oxi hóa của Br2: A. mạnh hơn Flo nhưng yếu hơn Clo. B. mạnh hơn Clo nhưng yếu hơn Iot. C. mạnh hơn Iot nhưng yếu hơn Clo. D. mạnh hơn Flo nhưng yếu hơn Iot. Câu 6: Trong phản ứng hóa học sau, Brom đóng vai trò là SO2 + Br2 + 2H2O H2SO4 + 2HBr A. Chất khử. B.Vừa là chất oxi hóa vừa là chất khử. C.Chất oxi hóa. D.Không là chất oxi hóa không là chất khử. Câu 7: Chất khí có thể làm mất màu dung dịch nước Brom là: A. SO2. B. CO2. C. O2. D. HCl. Câu 8: Đổ dd chứa 1 g HBr vào dd chứa 1 g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu: A. Màu đỏ. B. Màu xanh. C. Không màu. D. Màu tím. Câu 9: Chất A là muối Canxi halogenua. Dung dịch chứa 0.200 g A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0.376 g kết tủa bạc halogenua. Công thức phân tử của chất A là: A. CaF2. B. CaCl2. C. CaBr2. D. CaI2. Câu 10: Phát biểu nào sau đây không chính xác: A. Halogen là những phi kim điển hình, chúng là những chất oxi hóa. B. Trong hợp chất các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7. C. Khả năng oxi hóa của halogen giảm dần từ flo đến iot D. Các halogen khá giống nhau về tính chất hóa học. Câu 11: Sắp xếp theo chiều tăng tính oxi hóa của các nguyên tử là: A. I, Cl, Br, F B. Cl,I,F,Br. C. I,Br,Cl,F D. I,Cl,F,Br Câu 12: Các dãy chất nào sau đây mà các nguyên tử nguyên tố halgen có số oxi hoá tăng dần : A. HBrO,F2O,HClO2,Cl2O7, HClO3. B. F2O, Cl2O7, HClO2, HClO3, HBrO. C. F2O, HBrO, HClO2, HClO3, Cl2O7. D. HClO3, HBrO, F2O, Cl2O7, HClO2. Câu 13: Trong hợp chất, nguyên tố Flo thể hiện số oxi hóa là: A. 0 B. +1 C. -1 D. +3 Câu 14: Cho dung dịch AgNO3dư vào 100ml dung dịch chứa hổn hợp NaF 1M và NaBr 0,5M. Lượng kết tủa thu được là: A. 22,1g. B. 10g. C. 9,4g D. 8,2g. Câu 15: Nhóm chất nào sau đây chứa các chất tác dụng được với F2? A. H2, Na, O2. B. Fe, Au, H2O. C. N2, Mg, Al. D. Cu, S, N2. Câu 16: Cấu hình electron lớp ngoài cùng của các nguyên tử Halogen là: A. ns2 np4. B. ns2 np5 C. ns2 np6 D. (n – 1)d10 ns2 np5. Câu 17: Cấu hình electron lớp ngoài cùng của các ion Halogenua (X-) là: A. ns2 np4. B. ns2 np5 C. ns2 np6 D. (n – 1)d10 ns2 np5. Câu 18: Trong nước clo có chứa các chất: A. HCl, HClO B. HCl, HClO, Cl2 C. HCl, Cl2 D. Cl2 Câu 19: Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư thu được dung dịch chứa các chất thuộc dãy nào sau đây? A. KCl, KClO3, Cl2 B. KCl, KClO, KOH C. KCl, KClO3, KOH D. KCl, KClO3 Câu 20: Hòa tan khí Cl2 vào dung dịch NaOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất A. NaCl, NaClO3, Cl2 B. NaCl, NaClO, NaOH C. NaCl, NaClO3, NaOH D. NaCl, NaClO3 Câu 21: Có ba lọ đựng ba khí riêng biệt là clo, hidroclorua và oxi. Có thể dùng một chất nào trong số các chất sau để đồng thời nhận ra được cả ba khí trên? A. Giấy quỳ tím tẩm ướt B. Dd Ca(OH)2 C. Dd BaCl2 D. Dd H2SO4 Câu 22: Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể A. nung nóng hổn hợp. B. cho hổn hợp tác dụng với dung dịch HCl đặc. C. cho hổn hợp tác dụng với Cl2 sau đó đun nóng. D. cả A, B và C. Câu 23: Để điều chế clo, người ta có thể làm như sau: A. Điện phân muối NaCl nóng chảy hoặc dung dịch NaCl bão hòa có màng ngăn. B. Cho KMnO4 hoặc MnO2 tác dụng với dung dịch HCl đặc. C. Cho KClO3 tác dụng với dung dịch HCl đặc. D. A hoặc B hoặc C. Câu 24: Dãy gồm các chất đều phản ứng với dung dịch HCl là: A. NaOH, Al, CuSO4, CuO. B. Cu(OH)2, Cu, CuO, Fe. C. CaO, Al2O3, Na2SO4, H2SO4. D. NaOH, Al, CaCO3, Cu(OH)2, Fe, CaO, Al2O3. Câu 25: Cho axit sunfuric đậm đặc tác dụng với 58,5g Natri clorua, đun nóng. Hòa tan khí tạo thành vào 146 g nước. Tính nồng độ phần trăm dung dịch thu được A. 25%. B. 20%. C. 2,5%. D. 0.2% Câu 26: Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là: A. Fe. B. Zn. C. Cu. D. Ag. Câu 27: Cho 17,4 gam MnO2 tác dụng với dd HCl đặc, dư và đun nóng. Thể tích khí thoát ra (đktc) là: (Mn = 55) A. 4,48 lít. B. 2,24 lít. C. 3,36 lít. D. 6,72 lít. Câu 28: Cho 56 lít khí clo (ở đktc) đi qua một lượng dư dung dịch nước vôi trong. Khối lượng clorua vôi tạo thành là: A. 254g. B. 355g. C. 317,5g. D. 190,5g. Câu 29: Có 4 bình mất nhãn đựng các dd : HCl, HNO3, KCl, KNO3. Để phân biệt các dd trên, ta lần lượt dùng các chất A. dùng quì tím, dd AgNO3 B. dùng phenolphtalein, dd AgNO3 C. dd AgNO3, dd BaCl2 D. Tất cả a, b, c sai Câu 30: Có 4 bình mất nhãn đựng các dd :NaCl, NaNO3, BaCl2, Ba(NO3)2. Để phân biệt các dd trên, ta lần lượt dùng chất : A. quì tím, dd AgNO3 B. dd Na2CO3, dd H2SO4 C. dd AgNO3, dd H2SO4 D. dd Na2CO3, dd HNO3 Câu 31: Để phân biệt 5 dd riêng biệt sau: NaCl, NaBr, NaI, NaOH, HCl. Ta có thể dùng nhóm thuốc thử nào sau đây: A. khí Clo, dd AgNO3 B. quì tím, khí Clo C. quì tím, dd AgNO3 D. cả b, c đúng Câu 32: Có 6 dd riêng biệt sau: NaCl, NaBr, KI, HCl, H2SO4, KOH. Để phân biệt các dd trên, ta có thể dùng lần lượt các hợp chất sau: A. quì tím, khí Clo B. dd AgNO3, khí Clo C. quì tím, AgNO3, dd BaCl2 D. Cả a, b, c đều đúng Câu 33: Nếu lấy khối lượng KMnO4 , MnO2, KClO3 bằng nhau để cho tác dụng với dd HCl đặc, dư thì chất nào cho nhiều Clo hơn? A. MnO2 B. KClO3 C. KMnO4 D. cả 3 chất như nhau Câu 34: Cho 23,5 g hỗn hợp 2 kim loại đứng trước H tác dụng vừa đủ với dd HCl thu được 12,32 lít H2 (đktc) và dd Y. Cô cạn dd Y thu được khối lượng muối khan là: A. 55,62 g B. 52,65 g C. 56,25 g D. 62,55 g Câu 35: Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 g dd HCl 10%. Cô cạn dd thu được 13,15 g muối. Giá trị m là: A. 7,05 g B. 5,3 g C. 4,3 g D. 6,05 g Câu 36: Cho 12,1 g hỗn hợp Zn, Fe tác dụng với vừa đủ với m g dd HCl 10%. Cô cạn dd thu được 19,2 g muối. Giá trị m là: A. 73 g B. 53 g C. 43 g D. 63 g Câu 37: Hoà tan 9,14 g hỗn hợp Cu, Mg, Al bằng một lượng vừa đủ dd HCl được 7,84 lít khí H2 (đktc) và 2,54 g rắn Y và dd Z. Cô cạn dd Z thu được khối lượng muối khan là: A. 31,45 g B. 33,25 g C. 39,9 g D. 35,58 g o Câu 38:Cho 13,44 lít khí Cl2 (đktc) qua 2,5 lít dung dịch KOH ở 100 C. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là A. 0,24M. B. 0,48M. C. 0,2M. D. 0,4M. Câu 39: Hoà tan hoàn toàn 10,05 gam hỗn hợp 2 muối cacbonat kim loại hoá trị II và III vào dung dịch HCl thu được dung dịch A và 0,672 lít khí (đktc). Khối lượng muối trong A là A. 10,38gam. B. 20,66gam. C. 30,99gam. D. 9,32gam. Câu 40: Hoà tan 174 gam hỗn hợp M2CO3 và M2SO3 (M là kim loại kiềm) vào dung dịch HCl dư. Toàn bộ khí CO2và SO2 thoát ra được hấp thụ tối thiểu bởi 500ml dung dịch NaOH 3M. Kim loại M là A. Li. B. Na. C. K. D. Rb
File đính kèm:
 on_tap_hoa_hoc_lop_10_halogen_truong_thpt_doan_ket.docx
on_tap_hoa_hoc_lop_10_halogen_truong_thpt_doan_ket.docx

